Por ultimo les dejaremos un vídeo que hicimos comprobando algunas leyes de los gases.
domingo, 17 de enero de 2016
viernes, 15 de enero de 2016
Explicación de Einstein sobre el Movimiento Browniano:
Las moléculas del líquido se mueven aleatoriamente. Así una pequeña partícula suspendida en el líquido recibe un numero aleatorio de impacto de intensidad aleatoria y desde direcciones aleatorias en cualquier periodo corto de tiempo. Este bombardeo aleatorio por parte de las moléculas del liquido ocasiona el "Movimiento Browniano" de las partículas suspendidas.
Bibliografía:
http://www.academia.edu/3821494/ALBERT_EINSTEIN_Y_EL_MOVIMIENTO_BROWNIANOMOVIMIENTO_BROWNIANO_Movimiento_irregular_de_part%C3%ADculas_microsc%C3%B3picas_suspendidas_en_un_l%C3%ADquido_Precursores_del_trabajo_de_Brown_Leeuwenhoek_Spallanzani_Ingenhousz_Wrisberg_Drummond_M%C3%BCller
Movimiento Browniano
Recibe su nombre en honor al escocés Robert Brown, biólogo y botánico que
descubrió éste fenómeno en 1827 y observó que pequeñas partículas de polen
se desplazaban en movimientos aleatorios sin razón aparente.
El movimiento browniano es el movimiento aleatorio que se observa en algunas
partículas microscópicas que se hallan en un medio fluido (por ejemplo, polen
en una gota de agua).El movimiento aleatorio de estas partículas se debe a que su superficie es bombardeada incesantemente por las moléculas (átomos) del fluido sometido a una agitación térmica; este bombardeo a escala atómica no es siempre completamente uniforme y sufre variaciones estadísticas importantes. Así, la presión ejercida sobre los lados puede variar ligeramente con el tiempo, y así se genera el movimiento observado.
Tanto la difusión como la ósmosis se basan en el movimiento browniano.
Bibliografía:
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen1/ciencia2/13/htm/sec_4.html
jueves, 14 de enero de 2016
aplicación de las leyes de los gases.
Los gases tienen diversas aplicaciones, son utilizados para acelerar o frenar procesos, calentar, enfriar, alterar o preservar productos.aplicaciones en la medicina
Cámara hiperbárica :La medicina hiperbárica se fundamenta en las leyes físicas de los gases, que sostiene que al aumentar la presion aumenta la solubilidad del gas (oxigeno) en un líquido (plasma sanguíneo).
Al proveer al cuerpo de grandes cantidades de oxígeno se restablecen las funciones que se pierden cuando la cantidad es baja. Así, al aumentar de 10 a 15 veces más a cantidad de Oxígeno en el cuerpo se crean varios efectos como:
- La reducción de las inflamaciones.
- La mejora de la circulación sanguínea.
- La aceleración de las cicatrizaciones.
- La generación de nuevos vasos sanguíneos en áreas con circulación pobre.
- La remodelación de los huesos dañados.
- El aumento de la elasticidad del eritrocito, para favorecer la circulación en los pequeños vasos sanguíneos.
| http://www.semh.eu/tratamientos/ |
Aplicación de las leyes de los gases a la respiración.
- Leyes de la difusión de los gases
Ley de Charles
A una presión constante, aumenta la Tª, el V del gas aumenta y al disminuir la Tª, el volumen del gas disminuye. Esto se debe a que la temperatura significa movimiento de partículas. Así que, a mayor movimiento de partículas (temperatura), mayor volumen ocupa el gas.
La ley de Charles se aplica en la dinámica respiratoria.Cuando el aire entra en los pulmones, generalmente mas calientes que el ambiente, se expande aumentando el Vp.
Ley de los gases ideales
Es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). Los gases reales que mas se aproximan al comportamiento son los gases en condiciones de P baja y alta T.
Empíricamente se observa una serie de reacciones entre T, la P y el v que dan lugar a las leyes de los gases ideales, deducid por primera vez por Emile Clapeyron en 1834. La ecuación que describe normalmente la relaciona entre la P, el V, la T y la cantidad (en moles) de un gas ideal es:
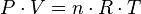
Donde P es presión, V es volumen, n es moles del gas, R es la constante universal de los gases ideales y T es temperatura absoluta.
Bibliografía: http://gredos.usal.es/jspui/bitstream/10366/83312/1/DC_Mart%C3%ADnezRagu%C3%A9s_Gema_Utilidad.pdf
Aplicación de las leyes de los gases a la respiración.
Principios biofísicos de la difusión de gases
Se llama difusión al proceso por el cual una sustancia se desplaza desde una zona de concentración elevada hacia otra de menor concentración hasta establecer un equilibrio. Para comprender el comportamiento de los gases en un enfoque fisiológico necesitamos conocer algunas leyes físicas por las que se rigen.
Bibliografía: http://gredos.usal.es/jspui/bitstream/10366/83312/1/DC_Mart%C3%ADnezRagu%C3%A9s_Gema_Utilidad.pdf
Se llama difusión al proceso por el cual una sustancia se desplaza desde una zona de concentración elevada hacia otra de menor concentración hasta establecer un equilibrio. Para comprender el comportamiento de los gases en un enfoque fisiológico necesitamos conocer algunas leyes físicas por las que se rigen.
- Leyes de la difusión de los gases:
Ley de Boyle-Mariotte :el volumen de un gas, es inversamente proporcional a la presión que ejerce:
P • V = k
Donde k es constante si la temperatura (Tª ) y la masa del gas permanecen constantes. Cuando aumenta la presion (P), el volumen (V) disminuye, mientras que si la P disminuye, el V aumenta.
PıVı=P2V2
La ley de Boyle permite explicar la ventilación pulmonar , el proceso por el que se intercambian gases entre la atmósfera y los alvéolos pulmonares. El aire entra en los pulmones porque la presión interna de estos es inferior a la atmosférica y por lo tanto existe un gradiente de presion. Inversamente, el aire es expulsado de los pulmones cuando estos ejercen sobre el aire contenido una presión superior a la atmosférica.
Bibliografía: http://gredos.usal.es/jspui/bitstream/10366/83312/1/DC_Mart%C3%ADnezRagu%C3%A9s_Gema_Utilidad.pdf
domingo, 10 de enero de 2016
Leyes de lo gases en medicina
Gases ideales
Los gases anestésicos solo se comportan como gases ideales en rangos de temperaturas y presiones muy pequeñas , ya que muchos de ellos a temperatura ambiente son líquidos.Los gases ideales poseen la característica de que su fuerza de atracción es despreciable razón que hace que el volumen sea infinitamente pequeño
Almacenamiento de gases en medicina
Para almacenar la mayor cantidad de gas en un recipiente de manera segura se aumenta la presión de acuerdo a la ley de los gases de Boyle y se disminuye la presión según la ley de Gay Lussac , hasta los limites permitidos de esta forma el gas se enfría permitiendo almacenado de forma liquida.
 |
| http://image.slidesharecdn.com/manejodeldrenajepleuralencuidadosintensivos-110419145628-phpapp01/95/manejo-del-drenaje-pleural-en-cuidados-intensivos-9-728.jpg?cb=1303225146 |
Anestesia y reanimacion en condiciones hipobaricas
Para esto se debe tener en cuenta los cambio físicos de la altitud , puesto que existe en menor margen de seguridad para mantener la presión de oxigeno adecuada , pero mayor requerimiento de oxigeno par mantener los niveles de PaO2 iguales al nivel de el mar.Se deben utilizar gases anestésicos guiadnos por su presión y no por su concentración.
En el efecto de os gases anestésicos la altura es directamente proporcional a la presión parcial, por eso al aumentar la altitud no aumenta la presión alveolar
Referencias
- Datos tomados de la presentación "leyes de los gases"elaborada por David Alejando Roncancio , y publicada el 3 de enero de el 2012
- Liga: http://es.slideshare.net/anestesiahsb/leyes-de-los-gases-david
lunes, 4 de enero de 2016
Ley de Charles
Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuye.
El volumen es directamente proporcional a la temperatura del gas.
- Si la temperatura aumenta, el volumen del gas aumenta.
- Si la temperatura del gas disminuye, el volumen del gas disminuye.
Ley combinada de los gases
Ley de los gases que combina la ley de Boyle, la ley de Charles, y la ley de Gay-Lussac. Estas leyes matemáticamente se refiere a cada una de las variables termodinámicas con relación a otra, mientras todo lo demás se mantiene constante.
La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre si, siempre y cuando la presión se mantenga constante.
La ley de Boyle afirma que la presion y el volumen son inversamente proporcionales entre si a temperatura constante.
Finalmente la ley de Gay- Lussac explica una proporcionalidad directa entre la temperatura y la presion, siempre y cuando se mantengan a un volumen constante.
La interdependencia de estas leyes se encuentra en la ley de los gases combinados que establece lo siguiente:
La relación entre el producto presion-volumen y la temperatura de un sistema permanece constante.
Ley de Avogadro
Esta ley fue descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad del gas y su volumen cuando se mantiene constantes la temperatura y la presión.
Entonces el volumen es directamente proporcional a la cantidad del gas.
- Si aumenta la cantidad del gas, aumentará el volumen.
- Si disminuimos la cantidad del gas, disminuye el volumen.
Ley de Gay-Lussac
Enunciada por Joseph Louis Gay-Lussac. Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La presión del gas es directamente proporcional a su temperatura, es decir:
- Si aumentamos la temperatura, aumentará la presión
- Si disminuimos la temperatura, disminuye la presión
Ley de Boyle
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
El volumen es inversamente proporcional a la presión, es decir:
- Si la presión aumenta, el volumen disminuye.
- Si la presión disminuye, el volumen aumenta.
sábado, 2 de enero de 2016
Explicaciones de la teoría cinética de la materia.
En este vídeo nos explica un poco más acerca de la teoría cinética de la materia, nos explica por ejemplo porque se enciende un fósforo, porque se expanden los gases entre otras cosas.
Suscribirse a:
Comentarios (Atom)


