- Leyes de la difusión de los gases
Ley de Charles
A una presión constante, aumenta la Tª, el V del gas aumenta y al disminuir la Tª, el volumen del gas disminuye. Esto se debe a que la temperatura significa movimiento de partículas. Así que, a mayor movimiento de partículas (temperatura), mayor volumen ocupa el gas.
La ley de Charles se aplica en la dinámica respiratoria.Cuando el aire entra en los pulmones, generalmente mas calientes que el ambiente, se expande aumentando el Vp.
Ley de los gases ideales
Es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). Los gases reales que mas se aproximan al comportamiento son los gases en condiciones de P baja y alta T.
Empíricamente se observa una serie de reacciones entre T, la P y el v que dan lugar a las leyes de los gases ideales, deducid por primera vez por Emile Clapeyron en 1834. La ecuación que describe normalmente la relaciona entre la P, el V, la T y la cantidad (en moles) de un gas ideal es:
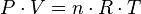
Donde P es presión, V es volumen, n es moles del gas, R es la constante universal de los gases ideales y T es temperatura absoluta.
Bibliografía: http://gredos.usal.es/jspui/bitstream/10366/83312/1/DC_Mart%C3%ADnezRagu%C3%A9s_Gema_Utilidad.pdf
No hay comentarios:
Publicar un comentario